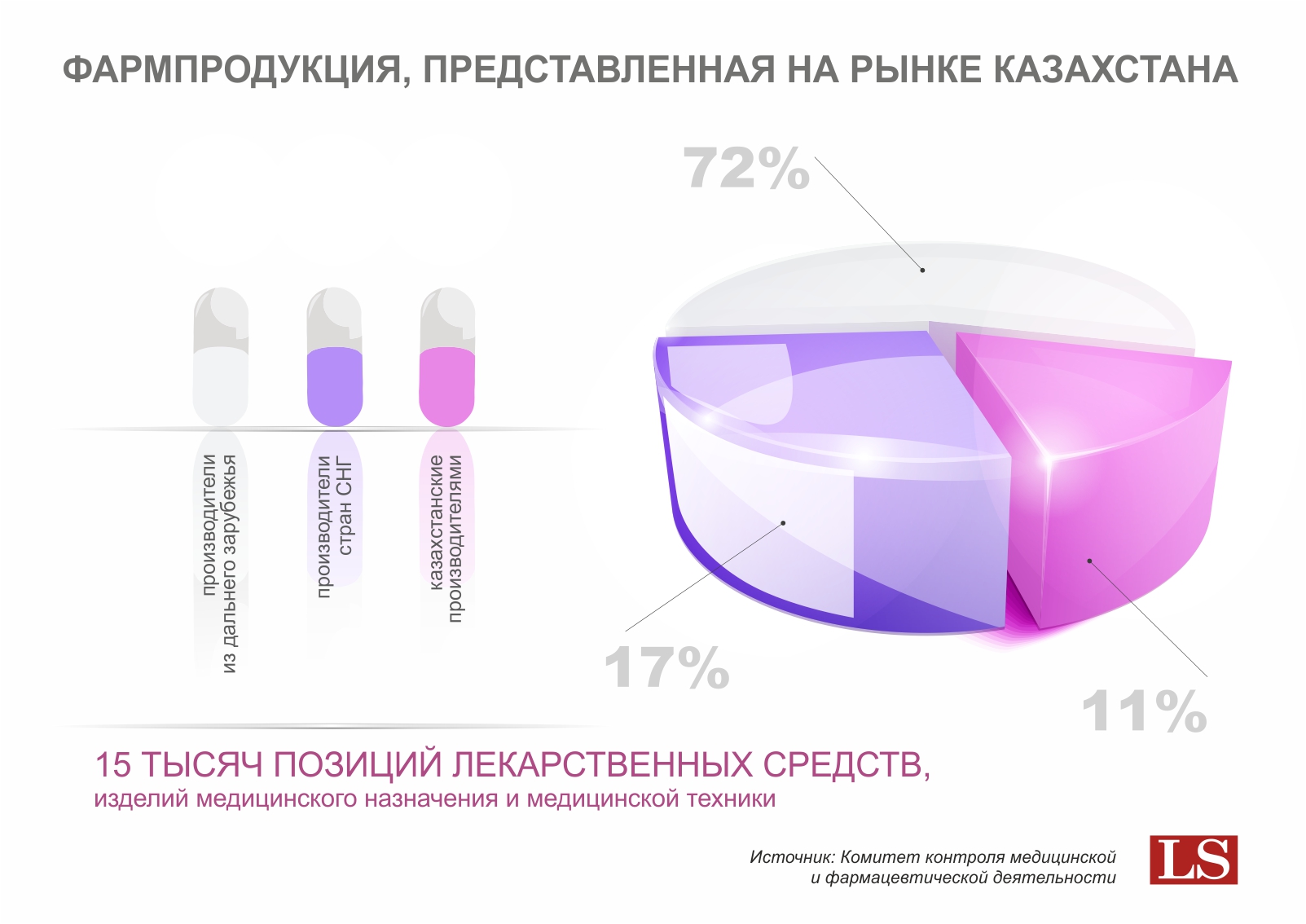
Как отмечают в комитете, одним из решений вопросов повышения безопасности и качества медицинской продукции является переход от системы контроля качества готовой продукции к системе обеспечения качества. В частности, речь идет о внедрении международных стандартов надлежащих фармацевтических практик.
«Стандарты надлежащих фармацевтических практик устанавливают требования к продукции, процессам, фармацевтическим услугам, участникам фармацевтического рынка на протяжении всего жизненного цикла фармацевтической продукции, начиная от разработки препарата до использования его потребителем. Для отечественных предприятий остается важным вопрос внедрения стандартов надлежащих производственных практик (GMP). В настоящее время девять отечественных производственных площадок имеют GMP, осуществляют подготовку к внедрению GMP еще семь предприятий», - говорится в сообщении комитета.
Напомним, согласно договору о Евразийском экономическом союзе, с 1 января 2016 года начнет функционировать общий рынок лекарственных средств, соответствующих стандартам надлежащих фармацевтических практик.
В свою очередь сами производители считают, что стандарты GMP помогут местным игрокам удержать долю на рынке. «В Казахстане подход правительства и медицинских ведомств к производителям при инспектировании на соответствие этим стандартам очень строгий. И стоит отметить, что требования в Казахстане сейчас помогают защитить наш рынок от некачественных медикаментов. В целом ЕАЭС ведет процесс ужесточения требований к GMP, приближая их к европейским», - отметил генеральный директор представительства Polpharma в Казахстане, инвестора компании Santo (торговая марка «Химфарм»), Петр Милднер.
Как отмечают в комитете, одним из решений вопросов повышения безопасности и качества медицинской продукции является переход от системы контроля качества готовой продукции к системе обеспечения качества. В частности, речь идет о внедрении международных стандартов надлежащих фармацевтических практик.
«Стандарты надлежащих фармацевтических практик устанавливают требования к продукции, процессам, фармацевтическим услугам, участникам фармацевтического рынка на протяжении всего жизненного цикла фармацевтической продукции, начиная от разработки препарата до использования его потребителем. Для отечественных предприятий остается важным вопрос внедрения стандартов надлежащих производственных практик (GMP). В настоящее время девять отечественных производственных площадок имеют GMP, осуществляют подготовку к внедрению GMP еще семь предприятий», - говорится в сообщении комитета.
Напомним, согласно договору о Евразийском экономическом союзе, с 1 января 2016 года начнет функционировать общий рынок лекарственных средств, соответствующих стандартам надлежащих фармацевтических практик.
В свою очередь сами производители считают, что стандарты GMP помогут местным игрокам удержать долю на рынке. «В Казахстане подход правительства и медицинских ведомств к производителям при инспектировании на соответствие этим стандартам очень строгий. И стоит отметить, что требования в Казахстане сейчас помогают защитить наш рынок от некачественных медикаментов. В целом ЕАЭС ведет процесс ужесточения требований к GMP, приближая их к европейским», - отметил генеральный директор представительства Polpharma в Казахстане, инвестора компании Santo (торговая марка «Химфарм»), Петр Милднер.
Асель МАРАТОВА